Nuove terapie contro il cancro? Una questione di bilancio, tra ossidanti e antiossidanti
In molti tumori esiste una popolazione di cellule staminali che sono resistenti alla maggior parte delle terapie convenzionali e in molti casi sono responsabili dello sviluppo delle metastasi e delle recidive. Con il progetto STEMOX, vincitore di un finanziamento Marie Skłodowska-Curie (Individual Fellowship) presso UniTo, intendiamo sfruttare una caratteristica che regola il comportamento di queste cellule per un approccio terapeutico che possa aggredirle in modo selettivo.

Spesso sentiamo parlare nei media delle cellule staminali, ma cosa sono esattamente?
Le cellule staminali hanno due caratteristiche importanti: possono dividersi all’infinito e possono differenziarsi, cioè specializzarsi, in altri tipi cellulari con funzioni particolari. Così troviamo delle cellule staminali ematopoietiche, che possono cioè differenziarsi nei diversi tipi di cellule del sangue, o cellule staminali neurali, che si differenziano nei diversi tipi cellulari del tessuto nervoso.
È però meno noto il fatto che anche in molti tumori esiste una popolazione di cellule staminali, le cosiddette “cellule staminali tumorali”. Queste cellule hanno la capacità di duplicarsi per mantenere inalterato il loro numero e di differenziarsi nelle diverse cellule che caratterizzano il tumore. In più, le cellule staminali tumorali hanno la capacità di resistere alla maggior parte delle terapie convenzionali e in molti casi sono le responsabili dello sviluppo delle metastasi e della ricrescita dei tumori dopo il trattamento.
Le cellule staminali tumorali hanno la particolarità di avere una grande plasticità, sono infatti in grado di modificarsi sia da un punto di vista morfologico che funzionale, a seconda delle condizioni dell’ambiente circostante, chiamato microambiente tumorale [di questo meccanismo avevamo parlato anche nel racconto “Come un pesce pagliaccio: la simbiosi tra tumore e microambiente per sfuggire alle cure”, NdR.]. È proprio questa plasticità che conferisce alle cellule staminali tumorali la capacità di generare tumori, uscire dai loro confini, attraversare i vasi sanguigni e infine colonizzare altri organi per formare metastasi.
È chiaro che queste cellule sono un nemico da non sottovalutare. Come possiamo attaccarle ed eliminarle in modo efficiente? La chiave potrebbe essere nascosta nel bilancio tra ossidanti e antiossidanti.
Ogni volta che un atomo cede un suo elettrone a un altro atomo siamo di fronte a una reazione di ossidoriduzione, o “redox”. L’atomo che perde il suo elettrone è detto riducente, mentre quello che lo riceve è detto ossidante. I famigerati radicali liberi, di cui talvolta si sente parlare anche nelle pubblicità, sono atomi che, perduto il proprio elettrone, si trovano in una situazione di disequilibrio e provano a strappare l’elettrone mancante agli atomi vicini. I radicali liberi sono quindi responsabili dell’avvio di una reazione a catena in cui gli atomi si “rubano” elettroni a vicenda e che porta al danneggiamento della cellula: ecco perché li sentiamo spesso nominare quando si parla di invecchiamento! A contrastare questo processo ci sono gli antiossidanti, sostanze in grado di neutralizzare i radicali liberi e proteggere l’organismo dalla loro azione negativa.
Molto di recente è stato ipotizzato che la regolazione redox svolga un ruolo importante nel controllo della plasticità delle cellule staminali tumorali. Quando queste si attivano dando luogo alla proliferazione tumorale, da un lato producono una grande quantità di radicali dell’ossigeno, dall’altro possiedono un sistema antiossidante (e quindi per così dire “protettivo” di sé stesse) potentissimo: sono proprio queste le caratteristiche che intendiamo sfruttare per selezionarle ed eliminarle.
Queste proprietà delle cellule staminali tumorali non sono ancora molto studiate. Il nostro obiettivo è approfondire i meccanismi che regolano questo metabolismo redox, per poterlo controllare a nostro piacimento. Vogliamo infatti modulare il bilancio redox nelle cellule staminali tumorali e sfruttarlo come approccio terapeutico innovativo per aggredire selettivamente queste cellule. A tal fine utilizzeremo dei nuovi sensori molecolari redox che ci permettono di valutare e controllare la produzione di radicali dell’ossigeno in queste cellule.
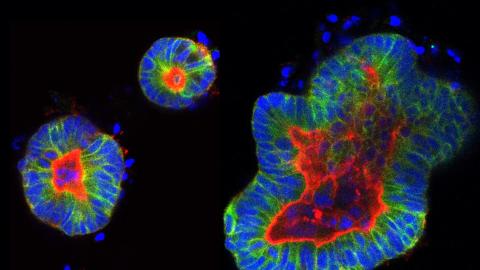
Esiste poi un secondo ma non meno importante aspetto innovativo del progetto. Riteniamo che condurre questo studio semplicemente su cellule in coltura , come viene più comunemente fatto in ricerche di questo tipo, possa avere limitazioni, poiché queste non riflettono l’alta eterogeneità riscontrata nei tumori dei pazienti e costituiscono un modello bidimensionale, che si sviluppa cioè in piano. Noi utilizzeremo un nuovo approccio: gli organoidi derivati dai pazienti, che si sono rivelati un ottimo modello tridimensionale per la ricerca in oncologia, perché riproducono fedelmente il tumore di partenza, preservando tutti i suoi sottotipi cellulari, incluse le cellule staminali tumorali [a proposito degli organoidi, leggi anche Mini-organi in 3D: una nuova frontiera per la terapia del cancro al colon-retto, NdR].